Balanceo de una ecuación química
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Lo cual, existen distintos métodos, como los que veremos a continuación
Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las
Masas de los productos"
Veremos 2 tipos de balanceo de ecuaciones químicas:
- BALANCEO POR TANTEO
- OXIDO-REDUCCIÓN (REDOX)
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774. Dice lo siguiente
"En una reacción química, la masa de los reactantes es igual a la masa de los reactivos" por lo tanto "La materia no se crea ni se destruye, solo se transforma"
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
De esta manera, nos resulta más fácil, ya que el mayor conflicto que se genera durante el balanceo es causado principalmente por los oxígenos e hidrógenos.
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:

Continuamos: ¿Cuántos oxígenos hay en el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos
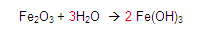
Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:
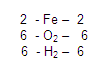
Por lo tanto, la ecuación está balanceada.
BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
- 1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
- 2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
- 3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
- 4. Los alcalinos tienen en sus compuestos oxidación +1
- 5. Los alcalinotérreos tienen en sus compuestos oxidación +2
- 6. Los alógenos tienen en sus compuestos con aluros oxidación -1
- 7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
- 8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su numero de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
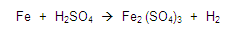
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
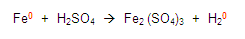
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
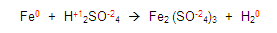
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
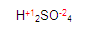
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
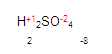
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
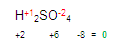
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
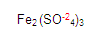
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
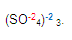
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
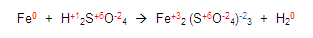
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
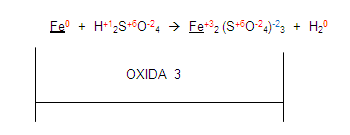
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
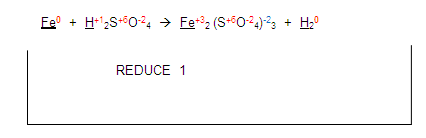
Entonces la ecuación queda de la siguiente manera:
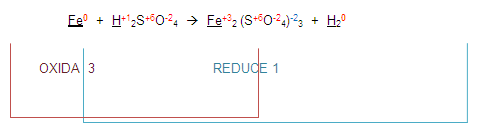
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
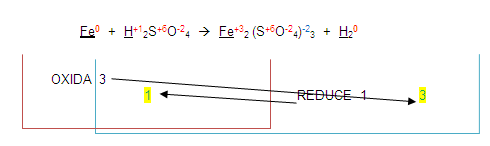
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
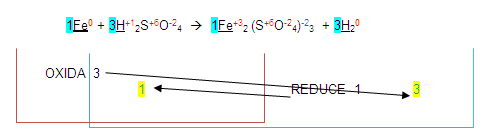
Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
Con esto finalizamos el método de REDOX.





No hay comentarios:
Publicar un comentario