Molaridad
Esta unidad de concentración se basa en el volumen de una solución y por
ello es conveniente utilizarla en los procedimientos del laboratorio en donde
la cantidad medida es el volumen de solución. La molaridad se define como el
número de moles de soluto por litro de solución (también como el número de
milimoles de soluto por mililitro de solución):
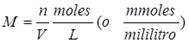
en donde M es la molaridad, n es el número de moles de soluto y V es el volumen
de solución expresado en litros. Ya que:
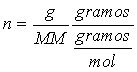
en donde g representa los gramos de soluto y MM la masa molecular del
soluto, de aquí que:
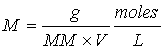
Cuando se da la información de la concentración de una especie química en
moles por litro esto se indica poniendo la fórmula de la especie dada entre
corchetes. Por ejemplo, [H+] = 0.1 nos indica que la concentración
de H+ es de 0.1 moles/litro.
Tratándose del equilibrio químico, es necesario distinguir entre la
concentración analítica que no es más que el número total de moles de un soluto
en un litro de solución y la molaridad analítica de una especie en equilibrio.
Por ejemplo, si añadimos 0.1 moles de ácido acético a un litro de agua,
tendremos una concentración analítica de ácido acético 0.1 molar. Sin embargo
en virtud del equilibrio:
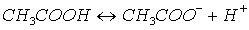
una fracción de las moléculas de ácido acético estará ionizada por lo que
la concentración real de la especie CH3COOH será menor que 0.1
molar.
Algunos reactivos de mucha aplicación en análisis químico son
manufacturados en estado líquido como una disolución concentrada de la
sustancia de interés. Entre estas sustancias tenemos la mayoría de los ácidos
que con mayor frecuencia se utilizan en los laboratorios como son el ácido
sulfúrico, clorhídrico, etc. En los frascos de estos ácidos concentrados nos
indican los fabricantes su porcentaje (% masa/masa) y densidad de la solución
del ácido. Con estos datos podemos calcular el volumen necesario del ácido
concentrado para preparar un ácido más diluido. Para ello nos basamos en la
masa de reactivo necesaria para preparar la solución es igual a la masa que
encontramos de ese reactivo en una solución concentrada. Por ejemplo para una
solución diluida cuya concentración se da en forma de molaridad:
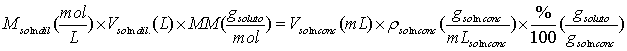
En general la ley de conservación de la masa, en este caso particular
aplicada a las soluciones, nos exige que el número de moles al preparar una
dilución de una solución se mantenga constante y esto se expresa por:
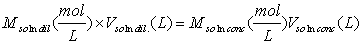
Ejemplos de cálculos relacionados con la molaridad.
Ejercicio 1. Calcule la molaridad de una solución que contiene 6.00 g de
NaCl (MM 58.44) en 200 ml de solución.
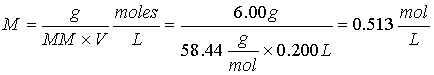
Ejercicio 2. Calcule el número de moles y el número de gramos de KMnO4 (MM
158.0) en 3.00 litros de una solución 0.250 M.
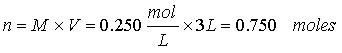
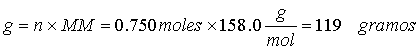





No hay comentarios:
Publicar un comentario