Estequiometría de gases
La estequiometría es la ciencia
que mide las proporciones cuantitativas o relaciones de masa de los elementos
químicos que están implicados. En una reacción químicase observa una
modificación de las sustancias presentes: los reactivos se consumen para dar
lugar a los productos.
En los compuestos iónicos no existen moléculas
aunque hablemos de «masa molecular». Utilizamos el término molécula para
indicar la relación mínima entre los iones que forman el compuesto.
Cálculos
estequiométricos
La estequiometría de una reacción nos indica la
relación en moles de las sustancias que intervienen en ella.
Si conocemos la masa o el volumen de alguno de los
reactivos o productos implicados, podemos calcular la masa o el volumen de las
otras sustancias que participan.
Interpretación cuantitativa de una ecuación química
Para calcular la cantidad de una sustancia que debe
reaccionar con una determinada cantidad de otra, o la cantidad de una sustancia
que se producirá si conocemos las cantidades de los reactivos, la ecuación
química debe estar ajustada.
Una ecuación
química ajustada nos aporta información acerca de las proporciones de las
sustancias que intervienen, tanto reactivos como productos
Cálculos
con volúmenes
Para determinar el volumen de un componente gaseoso
en una reacción química, hay que seguir un procedimiento similar al del ejemplo
anterior.
Veamos, en primer lugar, reacciones que tienen lugar
a 105 Pa de presión y a 273 K de temperatura. En estas condiciones, llamadas
condiciones normales, un mol de cualquier gas ocupa 22,4 L, que es el llamado
volumen molar (VM ).
Para determinar el volumen de un reactivo o un
producto, conociendo la masa o el volumen de otro componente de la reacción,
basta multiplicar el dato conocido por la relación entre el volumen y la masa,
o bien, entre los volúmenes de ambas sustancias, que se deriva de la ecuación
ajustada.
Estequiometría
con gases
Son
las relaciones estequiométricas cuando reaccionan gases
EJEMPLO
1.- Calcular el volumen de O2 (en litros) a TPE
que se requieren para completar la combustión de 2.65 L de acetileno (C2H2) a TPE.

Analizando
el problema podemos darnos cuenta de que la temperatura y la presión permanecen
constantes, por lo cual lo único que puede llegar a cambiar son los moles y el
volumen.
Para encontrar los moles, vamos a balancear
la ecuación química:
Por lo
tanto, este problema podríamos resolverlo con la ley de Avogadro de la
siguiente forma:
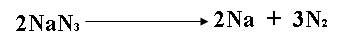
2.- La
azida de sodio (NaN3)
se usa en bolsas de aire de los automóviles. El impacto de una colisión produce
la descomposición de NaN3 como
lo muestra la reacción:
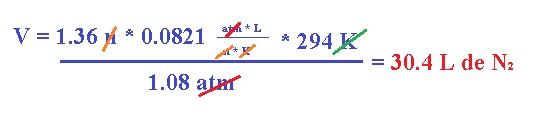
El
nitrógeno molecular producido infla la bolsa que se encuentra entre el
conductor y el volante. Calcula el volumen de N2 generado a 21°C y 823 mm Hg por la descomposición
de 59 g de NaN3.
Primero obtenemos moles de NaN3 en la masa:
Ahora,
procedemos a usar la ecuación de los gases ideales para obtener el volumen como
se hace normalmente, convirtiendo primeramente la temperatura a K y la presión
a atm:


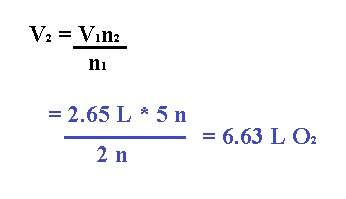
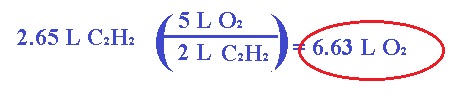
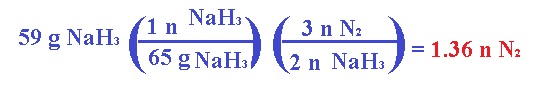




No hay comentarios:
Publicar un comentario