Molalidad
La
molalidad se define como la concentración de una solución, claro hablando en
términos químicos, la cual se refiere a la relación o proporción
que puede existir entre dos sustancias, conocidas en este medio como
soluto y la disolución, o componente a disolver.

La molalidad también se conoce por ser un término utilizado para indicar que se está procediendo a una concentración, la cual implica aumentar la proporción de un soluto en un solvente, mientras que el proceso contrario se conoce como dilución.
La Molalidad de una disolución viene determinada por la siguiente fórmula:
Molalidad (m) = n (nº de moles de
soluto
Kilogramos de disolvente
La
molalidad se expresa en las unidades (moles/Kg).
La
ventaja de usar la molalidad en lugar de molaridad (moles soluto /
volumen disolución) es debido a que el volumen de una disolución varía
con la temperatura y de la presión. Como la molalidad no tiene en cuenta el
volumen, puede medir la concentración con mayor preción.
En
el laboratorio, para medir la molalidad se emplea un vaso de precipitados y
pesando con una balanza analítica, previo peso del vaso vacío para restárselo.
Ejemplo 1:
Problema: ¿Cuál es la molalidad de una solución que contiene 0.086
moles de NaCl disuelto en 25,0 g de agua?
Respuesta: en este ejemplo se usa la ecuación directa de molalidad:
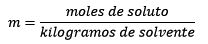
Moles de soluto (NaCl) = 0,086 mol
Masa (agua) = 25,0 g = 25,0 x 10-3 kg
Sustituyendo se tiene:
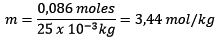





No hay comentarios:
Publicar un comentario