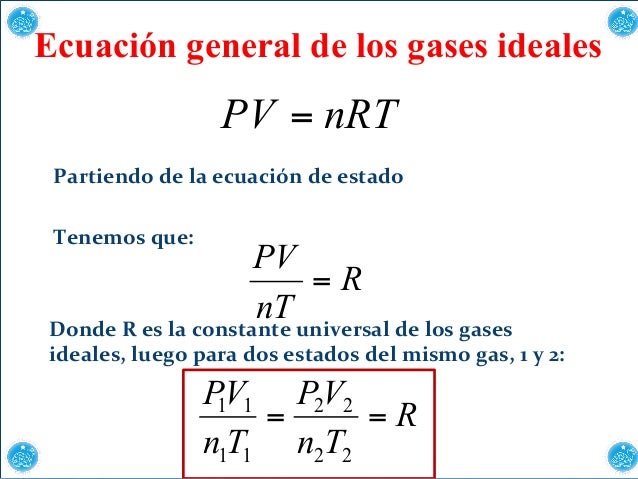
Ecuación del gas ideal
Esta ecuación explica la relación entre las 4 variables P,V,T y n. Un
gas ideal es un gas hipotético, cuyo comportamiento se puede explicar
completamente con la ecuación del gas ideal. Un gas ideal cumple con dos
requisitos fundamentales:
1. Las partículas del gas no se atraen o
repelen entre si.
2. El volumen del gas es despreciable en
comparación con el volumen del recipiente que los contiene.
Muchas veces el margen de error de algún gas
aplicando la ecuación del gas ideal es lo suficientemente pequeño como para no
alterar sustancialmente los cálculos, es por esto que la ecuación del gas ideal
es utilizada muchas veces para estudiar el comportamiento de ciertos gases.
Para
poder aplicar la ecuación del gas ideal en un sistema ideal debemos primero
calcular la constante R. Muchas
veces los gases tienen un comportamiento de gas ideal cuando están sometidos a
0°C (273.15 K) y 1 atm de presión. Cuando ocupamos un mol de algún gas bajo esas
condiciones de presión y temperatura este gas va a ocupar un volumen de 22,4 litros, que sería más o menos
el volumen que ocupa un balón de playa. Las condiciones de 0°C y 1 atm se
denominan Temperatura y Presión Estándar muchas
veces en química éste termino se abrevia como TPE.
¿CUÁL ES EL VALOR DE R?
Sabiendo cuales son las condiciones de un gas que tiene comportamiento de
gas ideal podemos despejar la constante R en nuestra ecuación de gas ideal y
reemplazar nuestras condiciones ideales, así, obtendremos el valor de la
constante.
despejamos R,
reemplazamos,
finalmente, 
Para efectos de calculo se utilizan hasta tres
cifras significativas dejando la constante en un valor de 0,0821 L•atm/mol•K y el valor de
los litros se ocuparan hasta dos cifras es decir 22,41 litros para el
volumen molar de un gas a TPE.
En
muchas ocasiones, los trabajos teóricos y experimentales se efectúan a la
presión de 1,013 × 105 Pa (1 atm) y a la temperatura de 273 K (0 °C). En estas
condiciones, un mol de cualquier gas ocupa 22,4 L.





No hay comentarios:
Publicar un comentario